Tartalom
A gyakran emlegetett BRCA génmutációk mellett jelentős számban vannak Egyéb örökletes génmutációk, amelyek növelik az emlőrák kialakulásának kockázatát. Valójában úgy gondolják, hogy több mint 100 gén mutációi hozzájárulnak a kockázathoz, és várhatóan nőni fog a nem BRCA génmutációk száma, amelyek emelik az emlőrák kockázatát, amint ismereteink a rák genetikájáról nőnek.A BRCA1 és BRCA2 génmutációk mellett ezek egy része magában foglalja az ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 stb. Mutációit. Vizsgáljuk meg, hogy ezek a nem BRCA1 / BRCA2 mutációk mennyire fontosak a családi emlőrákban, és melyek azok a jellemzők, amelyeket gyakrabban találnak meg.
Örökletes mellrák
Jelenleg úgy gondolják, hogy az emlőrák 5-10 százaléka genetikai vagy családi (bár ez a szám változhat, ha többet megtudunk), de nem mindegyik rák oka a BRCA mutációknak.
Legfeljebb 29 százalék (és valószínűleg sokkal kevesebb) örökletes emlőrák pozitív eredményt mutat a BRCA1 vagy BRCA2 génmutációkra, és sokan folytatják a többi ismert genetikai változás tesztelését.
Mivel az örökletes rák mögött álló tudomány nagyon szorongást vált ki, nem is beszélve zavarosról és hiányosról, hasznos kezdeni azzal, hogy a génmutációk biológiájáról beszélünk, és arról, hogy ezek a DNS-változások hogyan játszanak szerepet a rák kialakulásában.
Örökölt vagy megszerzett génmutációk
Amikor a mutációkról beszélünk, fontos különbséget tenni az öröklött és a megszerzett génmutációk között.
A megszerzett vagy szomatikus génmutációk az elmúlt években nagy figyelmet kaptak, mivel ezek a mutációk olyan változásokat okoznak, amelyek a rák növekedését ösztönzik. A célzott terápiák, az e változásokhoz kapcsolódó specifikus utakat célzó gyógyszerek jelentősen javították egyes rákos megbetegedések, például a tüdőrák kezelését.
A megszerzett mutációk azonban nem születésüktől fogva vannak jelen, hanem a születés után bármikor kialakulnak a sejt rákos sejtekké válásának folyamatában. Ezek a mutációk csak a test egyes sejtjeire hatnak. Nem öröklődnek egy szülőtől, hanem inkább "megszerzik", mivel a sejtekben lévő DNS ki van téve a környezet károsodásának vagy a test normális anyagcsere-folyamatainak eredményeként.
Az öröklött vagy csíravonal-mutációk ezzel szemben olyan genetikai változások, amelyekkel az emberek születnek, és amelyeket az egyik vagy mindkét szülő átad. Ezek a mutációk a test összes sejtjére hatással vannak. Ezek az öröklött mutációk (és egyéb genetikai változások) növelhetik annak esélyét, hogy egy személy rákot kapjon, és figyelembe vegyék az úgynevezett örökletes vagy családi emlőrákot.
Örökletes (Germline) vs. megszerzett (szomatikus) génmutációkHogyan növelhetik az örökletes génmutációk a rák kockázatát?
Sok ember kíváncsi arra, hogy egy abnormális gén vagy génkombinációk pontosan hogyan vezethetnek emlőrákhoz, és a biológia rövid áttekintése hasznos sok kérdés megértésében, például miért nem alakul ki rák mindenkinek, akinek ilyen mutációi vannak.
DNS-ünk egy terv vagy kód, amelyet fehérjék előállítására használnak. Ha a térkép vagy kód hibás (például egy adott génben a "betűk"), akkor rossz irányokat ad a fehérje szintetizálásához. A kóros fehérje ekkor nem képes ellátni szokásos munkáját. Nem minden génmutáció növeli a rák kockázatát, sőt, a legtöbb sem. A sejtek növekedéséért és osztódásáért felelős gének mutációi vagy a "hajtómutációk" vezérlik a rákos megbetegedések növekedését. Két fő géntípus létezik, amelyek mutációval rákként ismert, ellenőrizetlen növekedéshez vezethetnek: onkogének és tumorszuppresszor gének.
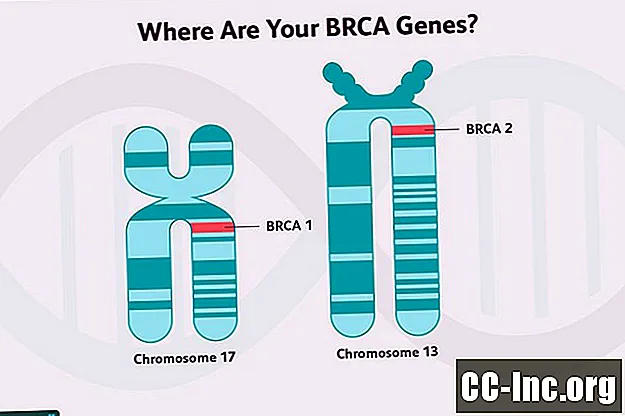
A magasabb emlőrák kockázatával járó gének közül több daganatelnyomó gén. Ezek a gének kódolják azokat a fehérjéket, amelyek a sejtekben lévő DNS károsodásának (a környezet toxinjainak vagy a sejtek normális anyagcsere-folyamatainak károsodásai) helyrehozására szolgálnak, a nem helyrehozható sejtek kiküszöbölését szolgálják, vagy más módon szabályozzák a növekedést. A BRCA1 és BRCA2 gének tumorszuppresszor gének.
Ezen gének közül sok autoszomális recesszív, ami azt jelenti, hogy minden ember örökli a gén egy példányát minden szülőtől, és mindkét kópiát mutálni kell a rák kockázatának növelése érdekében. Egyszerűbben ez azt jelenti, hogy genetikai és környezeti tényezők kombinációjának (a másik génben megszerzett mutáció) együtt kell működnie a rák kialakulásához. Ehhez hozzáadva általában több mutációnak is meg kell történnie ahhoz, hogy egy sejt ráksejtté váljon.
Mit jelent genetikai hajlam a rákraGén behatolás
Nem minden génmutáció vagy genetikai változás egyformán növeli az emlőrák kockázatát, és ez fontos fogalom mindenki számára, aki fontolgatja a genetikai tesztelést, különösen, mivel sokan hallottak a BRCA mutációk által okozott nagyon magas kockázatról. A gén penetranciát olyan mutációval rendelkező emberek arányának definiálják, akik megtapasztalják az állapotot (ebben az esetben mellrák alakul ki).
Egyes mutációk esetében az emlőrák kockázata nagyon magas. Másoknál a kockázat csak 1,5-szeresével növelhető. Ezt fontos megérteni, amikor a lehetséges megelőző lehetőségekről beszélünk.
Epigenetika
Egy másik fontos koncepció, amely fontos a genetika és a rák megértésében, bár túl bonyolult ahhoz, hogy itt részletesen feltárjam, az epigenetika. Megtudtuk, hogy a DNS olyan változásai, amelyek nem járnak az alappárok (nukleotidok) vagy a fehérjét kódoló "betűk" változásával, ugyanolyan fontosak lehetnek a rák kialakulásában. Más szavakkal, a DNS gerincében bekövetkező szerkezeti változások helyett lehetnek molekuláris változások, amelyek megváltoztatják az üzenet olvasásának vagy kifejezésének módját.
Nem BRCA génmutációk
A BRCA génmutációk a legismertebb emlőrákhoz kapcsolódó genetikai rendellenességek, de egyértelmű volt, hogy vannak olyan nők, akik családtörténetük alapján hajlamosak az emlőrákra, és negatív eredményt mutatnak.
Egy 2017-es tanulmány megállapította, hogy a BRCA mutációk az örökletes emlőráknak csak 9–29 százalékát tették ki. Még akkor is, ha további 20–40 ismert mutációt teszteltek, a nőknek csak 4–11 százaléka volt pozitív. Más szavakkal, az örökletes emlőrákban gyanús nők 64–86 százaléka mindkét BRCA-mutáció és 20–40 másik esetében negatívnak bizonyult.
Nem BRCA1 / BRCA2 családi mellrák
Az emlőrák kockázatát növelő génmutációkkal kapcsolatos ismereteink még mindig hiányosak, de ma már tudjuk, hogy legalább 72 génmutáció kapcsolódik az örökletes emlőrákhoz. Úgy gondolják, hogy ezek a mutációk (és mások még felfedezetlenek) felelősek az örökletes emlőrák 70–90 százalékáért, amelyek negatívnak bizonyítják a BRCA génmutációkat. A BRCAX rövidítést ezen egyéb mutációk leírására hozták létre, ami a nem BRCA1 BRCA2-vel kapcsolatos családi emlőrák.
72 örökletes emlőrákhoz kapcsolódó genetikai mutációkAz alábbi genetikai rendellenességek különböznek gyakoriságukban, a kapcsolódó kockázat mértékében, az emlőrák típusában és a mutációkhoz kapcsolódó egyéb rákos megbetegedésekben.
Ezeknek az emlőrákoknak a jellemzői (például a rák típusa, az ösztrogén-receptor státus és a HER2 státus) hasonlóak a nem örökletes vagy szórványos emlőrákokhoz, de vannak kivételek. Például egyes mutációk szorosabban kapcsolódnak a hármas negatív emlőrákhoz, ideértve a BARD1, BRCA1, BRCA2, PALB2, ésRAD51D.
Változás a mutációkon belül
Nem minden ember azonos, akinek a következő génmutációi vannak. Általánosságban elmondható, hogy több száz módon mutálódhatnak ezek a gének. Bizonyos esetekben a gén olyan fehérjéket termel, amelyek elnyomják a tumor növekedését, de a fehérjék nem működnek olyan jól, mint a normál fehérje. Más mutációkkal előfordulhat, hogy a fehérje egyáltalán nem termelődik.
BRCA (Rövid áttekintés az összehasonlításhoz)
A BRCA 1 génmutációk és a BRCA2 génmutációk mind az emlőrák, mind néhány más rák kialakulásának fokozott kockázatával járnak, bár ezek a kockázatok némileg eltérnek egymástól.
Átlagosan azoknak a nőknek 72 százaléka, akiknél BRCA1 mutáció van, és 69 százalékuknak, akik mutáltak BRCA2 géneket, 80 éves korukig mellrák alakul ki.
Ezenkívül az ezekhez a mutációkhoz kapcsolódó mellrák eltérhet. A BRCA1 mutációval rendelkező nők emlőrákai valószínűleg hármas negatívak. Körülbelül 75 százalékuk ösztrogén receptor negatív, és kevésbé valószínű, hogy HER2 pozitív. Nagyobb valószínűséggel magasabb a tumor fokozatuk is. A BRCA2 mutációval rendelkező nők mellrákja ezzel ellentétben hasonló a nők rákos megbetegedéseihez, akik nem BRCA génmutációs hordozók.
ATM gén (ATM szerin / treonin kináz)
Az ATM gén azokat a fehérjéket kódolja, amelyek segítenek szabályozni a sejtek növekedési sebességét. A sérült sejtek (a toxinokból származó DNS-károsodást szenvedő sejtek) helyreállításában is segítenek az ezt a kárt helyreállító enzimek aktiválásával.
Azoknak, akiknek a mutált gén két példánya van, ritka autoszomális recesszív szindróma van, amelyet ataxia-telangiectasia néven ismernek. Ataxia-telangiectasia esetén a hibás fehérjék nemcsak növelik a rák kockázatát, hanem azt is eredményezik, hogy az agy egyes sejtjei túl korán elhalnak, ami progresszív neurodegeneratív rendellenességet eredményez.
Azoknak az embereknek, akiknek csak egy mutált kópiája van a génnek (a lakosság nagyjából 1 százaléka), 20–60 százalékos az életük során fennálló kockázata az emlőrák kialakulásának.
Úgy gondolják, hogy ezen mutációval rendelkező emberek korai életkorban hajlamosak az emlőrákra, valamint a kétoldalú emlőrák kialakulására.
A mellrák szűrése mell-MRI-vel 40 éves kortól ajánlott, és a nők fontolóra vehetik a megelőző mastectomia kialakulását.A jelek szerint egy mutált ATM-génnel rendelkezők hajlamosak a pajzsmirigy- és hasnyálmirigyrákra, és érzékenyebbek a sugárzásra.
PALB2
A PALB2 gén mutációi szintén fontos okai az örökletes emlőráknak. A PALB2 gén egy olyan fehérjét kódol, amely a BRCA2 fehérjével együtt működik, hogy helyrehozza a sérült DNS-t a sejtekben. Összességében elmondható, hogy a PALB2 mutációval járó emlőrák kockázata egész életen át 58%, bár ez életkoronként változhat. A kockázat 8-9-szerese az átlagnak a 40 évesnél fiatalabb nőknél, de körülbelül ötszöröse a 60 év feletti nőknél.
Azok között, akik a gén egy példányát hordozzák, 14 százalékuk 50 éves korára, 35 százaléka 70 éves korára fejleszti az emlőrákot (kevesebb, mint BRCA-mutációk esetén).
Azoknál a betegeknél, akiknek PALB2 mutációja van és mellrákuk van, nagyobb a kockázata annak, hogy meghalnak a betegségtől.
Azoknál az embereknél, akik a mutált PALB2 gén 2 példányát öröklik, egyfajta Fanconi-vérszegénység jellemzi a vörösvértestek, a fehérvérsejtek és a vérlemezkék nagyon alacsony számát.
CHEK2
A CHEK2 gén egy olyan fehérjét kódol, amely akkor aktiválódik, amikor a DNS károsodik. Ez aktiválja a sejtek helyreállításában részt vevő más géneket is.
A CHEK2 csonkoló mutációk hordozóinak életre szóló kockázata 20% egy nőnél, akinek nincs érintett rokona, 28% egy nőnél, akinek egy másodfokú rokona érintett, 34% egy nőnél, akinek egy elsőfokú rokona érintett, és 44% egy nő, akinek mind az első, mind a másodfokú rokona érintett.
Mind a férfiak, mind a nők számára a gén növeli a vastagbélrák és a non-Hodgkin-limfóma kockázatát is.
CDH1
A CDH1 mutációi örökletes gyomorrák szindrómának nevezett állapotot okoznak.
Azok a személyek, akik öröklik ezt a gént, életük során akár 80 százalékos kockázatot jelentenek a gyomorrák kialakulásában, és 52 százalékos kockázatot jelentenek a lobuláris emlőrák kialakulásában.
A gén egy olyan fehérjét (epitheliális kadherin) kódol, amely segíti a sejtek egymáshoz tapadását (az egyik különbség a rákos sejtek és a normál sejtek között az, hogy a rákos sejtekben hiányoznak ezek az adhéziós vegyi anyagok, amelyek tapadást okoznak). A mutációt öröklő emberek rákja nagyobb valószínűséggel áttétképződik.
PTEN
A PTEN gén mutációi az egyik leggyakoribb tumor szuppresszor gén mutáció. A gén olyan fehérjéket kódol, amelyek szabályozzák a sejtek növekedését, és segítenek a sejtek összetartásában is.
Úgy tűnik, hogy a gén mutációi növelik annak kockázatát, hogy a rákos sejtek elszakadnak a daganattól és áttétet képeznek. A PTEN a PTEN hamartoma tumor szindrómának nevezett szindrómához, valamint a Cowden szindrómához társul.
A PTEN-mutációt hordozó nők életében az emlőrák kialakulásának kockázata akár 85 százalék, emellett jóindulatú mellváltozások, például fibrocisztás betegség, adenózis és intraductalis papillomatosis kockázata is fokozott.
A mutációk a méhrák (és a jóindulatú méh mióma), a pajzsmirigyrák, a vastagbélrák, a melanoma és a prosztatarák fokozott kockázatával is összefüggenek.
A nem rákkal kapcsolatos tünetek közé tartozik a nagy fejméret (makrocefália) és a jóindulatú daganatok kialakulására való hajlam, amelyet hamartomának neveznek.
STK11
Az STK11 mutációi a Peutz-Jegher-szindrómának nevezett genetikai állapothoz kapcsolódnak. Az STK11 egy tumor szupresszor gén, amely részt vesz a sejtek növekedésében.
A szindróma a mellrák megnövekedett kockázatának (akár 50 százalékos életkori kockázattal) mellett számos rákos megbetegedés megnövekedett kockázatát hordozza magában, amelyek közül néhány vastagbélrákot, hasnyálmirigyrákot, gyomorrákot, petefészekrákot, tüdőrákot, méhrák, és még sok más.
A mutációval összefüggő, nem rákkal kapcsolatos állapotok közé tartoznak az emésztőrendszerben és a húgyúti rendszerben előforduló nem rákos polipok, az arcon és a száj belsejében lévő szeplők és még sok más. Az emlőrák szűrését gyakran ajánlják a 20 év körüli nőknek, és gyakran MRI-vel mammográfiával vagy anélkül.
TP53
A TP53 gén olyan fehérjéket kódol, amelyek megállítják a kóros sejtek növekedését.
Ezek a mutációk rendkívül gyakoriak a rákban, a szerzett a p53 gén mutációi a rákos megbetegedések körülbelül 50 százalékában találhatók meg.
Az örökletes mutációk ritkábban fordulnak elő, és Li-Fraumeni-szindrómának vagy Li-Fraumeni-szerű szindrómának (amely alacsonyabb rákkockázattal jár) járó betegségekkel jár. A mutációt öröklő emberek többségénél 60 éves korig rák alakul ki, és az emlőrák mellett hajlamosak csontrák, mellékvese, hasnyálmirigyrák, vastagbélrák, májrák, agydaganatok, leukémia stb. Nem ritka, hogy a mutációt szenvedő embereknél egynél több elsődleges rák alakul ki.
Úgy gondolják, hogy a p53 gén öröklődő mutációi az örökletes emlőrák eseteinek körülbelül 1 százalékát teszik ki. A mutációval összefüggő emlőrákok gyakran HER2 pozitívak és magas tumor fokozatúak.
Lynch-szindróma
A Lynch-szindróma vagy az örökletes, nem polipózisos kolorektális rák számos különböző gén mutációival társul, beleértve a PMS2, MLH1, MSH2, MSH6 és EPCAM.
Különösen a PMS2 az emlőrák kockázatának kétszeresével társult. A gén tumorszuppresszor génként funkcionál, és kódol egy fehérjét, amely helyreállítja a sérült DNS-t.
Az emlőrák mellett ezek a mutációk nagy kockázatot jelentenek a vastagbél, a petefészek, a méh, a gyomor, a máj, az epehólyag, a vékonybél, a vese és az agy rákos megbetegedései szempontjából.
Egyéb mutációk
Számos más génmutáció is társul az emlőrák kialakulásának fokozott kockázatához, és várhatóan a közeljövőben még többet fognak felfedezni. Ezek egy része a következőket tartalmazza:
- BRIP1
- BARD1
- MRE11A
- NBN
- RAD50
- RAD51C
- SEC23B
- BLM
- MUTYH
Mellrák és genetikai tesztek
Jelenleg tesztek állnak rendelkezésre a BRCA génmutációkra, valamint az ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B és TP53 mutációkra, várhatóan ez a terület bővülni fog drámai módon a közeljövőben.
Ezen tesztek rendelkezésre állása azonban sok kérdést felvet. Például kinek lehet örökletes emlőrákja, és kit kell tesztelni? Mit kell tennie, ha ezeknek a géneknek az eredménye pozitív?
Ideális esetben bármilyen vizsgálatot csak genetikai tanácsadó irányításával és segítségével lehet elvégezni. Ennek két oka van.
Az egyik az, hogy pusztító lehet megtanulni, hogy olyan mutációt hordoz, amely növelheti a kockázatát, és annak ajánlása, aki ismeri az ajánlott kezelést és szűrést, felbecsülhetetlen.
Mint korábban említettük, egyes mutációk magas, mások sokkal alacsonyabb kockázatot jelentenek. Egyes mutációk az élet korábbi szakaszaiban (mondjuk 20 évesen) aggodalomra adhatnak okot, míg mások nem igényelhetik a korai szűrést. A genetikai tanácsadó segíthet megismerni az adott mutáció szűrése szempontjából jelenleg ajánlottakat, figyelembe véve az esetleges egyéb kockázati tényezőket.
A genetikai tanácsadás olyan fontos oka az, hogy akkor is jelentős a kockázata az emlőrák kialakulásának, ha a tesztje negatív. Sokat kell még megtanulni, és egy genetikai tanácsadó segíthet a családtörténetének megnézésében, hogy a negatív tesztek ellenére magas kockázatot hordozhat-e, és ennek megfelelően megtervezheti a szűrést.
Az emlőrák genetikai vizsgálataAz örökletes mellrák támogatása
Ahogyan azoknak az embereknek is támogatásra van szükségük, akiknél diagnosztizálták az emlőrákot, azoknak is szükségük van támogatásra. Szerencsére vannak olyan szervezetek, amelyek kifejezetten az emberek támogatására koncentrálnak ebben a helyzetben.
Az egyik szervezet, a FORCE, amely rövidítése annak, hogy szembesüljünk a rák kockázatával, felajánl egy segélyvonalat, egy üzenőfalat és információkat azok számára, akik örökletes rákkal szembesülnek.
Más szervezetek és támogató közösségek állnak rendelkezésre, amelyek segítenek az embereknek megbirkózni az örökletes emlőrák diagnózisával kapcsolatos döntésekben.
A "previvor" kifejezést a FORCE hozta létre azoknak az embereknek a leírására, akik túlélik az emlőrákra való hajlamot. Ha ilyen helyzetben van, akkor nem vagy egyedül, és a #previvor hashtag használatával sok más megtalálható a Twitteren és más közösségi oldalakon.
Egy szó Verywellből
Döbbenetes lehet megismerni a sokféle génmutációt, amelyek a BRCA mutációkon túl emelik az emlőrák kockázatát, de ezek az "egyéb" mutációk jelentős jelentőséggel bírnak, tudván, hogy a BRCA mutációk a családi emlőrákok viszonylagos kisebbségét teszik ki. Ugyanakkor az örökletes emlőrákot vizsgáló tudomány még mindig gyerekcipőben jár, és sok mindent meg kell tanulni. Ha aggódsz, előfordulhat, hogy van egy mutációd, vagy megtanultad, hogy megteszed, hasznos, ha megtanulsz minél többet. Az örökletes rákos szervezetek, mint például a FORCE, nem csak további információkat nyújthatnak Önnek, hanem kapcsolatba léphetnek másokkal is, akik hasonló kérdések és aggodalmak előtt állnak egy út előtt.