Tartalom
A nagysejtes tüdőrák (LCLC) a nem kissejtes tüdőrák számos formájának egyike. Az LCLC gyakran a tüdő külső régióiban alakul ki, és gyorsan növekszik, és agresszívebben terjed, mint a tüdőrák néhány más formája. Ellentétben néhány tüdőrákkal, amelyek általában köhögéssel vagy tüdőfertőzéssel járnak, a nagysejtű tüdő korai tünetei a carcinoma főleg a légszomj és a fáradtság homályos érzékét foglalja magában.A nem kissejtes tüdőrák az összes tüdőrák kb. 85% -át teszi ki, amelynek nagyjából 10% -a nagysejtes karcinóma. A nagysejtes tüdőrákokat, más néven nagysejtes tüdőrákokat, úgynevezettek, a rákos sejtek (szemben a daganat méretével, amely szintén elég nagy).
Nagysejtes tüdőrák tünetei
Mivel az LCLC tipikusan a tüdő külső perifériáiban alakul ki, a tüdőrák jól ismert tünetei (például krónikus köhögés és vérköhögés) ritkábban fordulnak elő a betegség későbbi szakaszában.
Az LCLC korai tünetei könnyen elmulaszthatók, és más kevésbé súlyos állapotoknak tulajdoníthatók, beleértve az életkort is. Ilyen tünetek lehetnek:
- Fáradtság
- Enyhe nehézlégzés (légszomj)
- A hát, a váll vagy a mellkas eredményessége
Az LCLC más tüneteket okozhat a betegség előrehaladtával. A daganat tüdő szélén való elhelyezkedése folyadékok felhalmozódását okozhatja a tüdő és a mellkas fala (pleurális üreg) közötti térben. Ez pleurális folyadékgyülemhez vezethet, olyan állapothoz, amelyet nehézlégzés és a mellkasban vagy az oldalakon fellépő fájdalom jelentkezik, amely mély lélegzéssel súlyosbodik.
Az LCLC olyan hormonszerű anyagokat is képes kiválasztani, amelyek paraneoplasztikus szindrómákként ismert állapotok sorozatát váltják ki. Ezek ritka rendellenességek, amelyekben az immunrendszer rendellenesen reagál a rákos daganatokra.
A paraneoplasztikus szindróma olyan tüneteket okozhat, mint a beszéd zavara, a finommotorikus képességek elvesztése, valamint járási vagy nyelési nehézségek. A férfiaknál a mell megnagyobbodását is okozhatja, amelyet gynecomastia néven ismerünk.
A paraneoplasztikus szindrómák az összes tüdőrák 5-10% -ában fordulnak elő, és a rosszindulatú daganat korai szakaszában kialakulhatnak. A paraneoplasztikus szindrómák jeleinek felismerése segíthet a tüdőrák korai diagnosztizálásában, miközben ez még mindig nagyon kezelhető.
A nem kissejtes tüdőrák jelei és tüneteiOkoz
A tudósok továbbra sem biztosak abban, hogy mi okozza az LCLC-t. A kutatások szerint bizonyos génmutációk hozzájárulhatnak a betegség kockázatához, ideértve a RUNX1, ERBB4, BRCA1 és EPHA3 gének mutációit is.
Az LCLA egyéb kockázati tényezői megegyeznek a tüdőrák minden más formájával. A fő közöttük a dohányzás. A dohányzás továbbra is a tüdőrák legnagyobb kockázati tényezője, és az LCLC sem kivétel. Még a dohányzóval való együttélés is 20-30% -kal növeli a nem dohányzó tüdőrák kockázatát.
Az otthoni radonnak való kitettség a tüdőrák második vezető kockázati tényezője. A természetes urán talajban történő bomlása okozza, hogy a radon túlzottan magas szinten található sok házban.
Noha a kissejtes tüdőrákok gyakrabban kapcsolódnak a radon-expozícióhoz, a radon még mindig jelentősen hozzájárulhat az LCLC és más nem kissejtes tüdőrákok kialakulásához. A radon-teszt kimutathatja, és az enyhítő szolgálatok eltávolíthatják.
A nem kissejtes tüdőrák kockázati tényezőiDiagnózis
A tüdőrákot gyakran akkor gyanítják először, ha rendellenességeket észlelnek a mellkas röntgenfelvételén. Ennek ellenére a "normális" mellkasröntgen nem zárhatja ki a rákot, mivel az ilyen típusú képalkotás során a kisebb daganatok általában hiányoznak.
Ha az LCLC bármely tünete fennáll, további vizsgálatokat kell folytatni, még akkor is, ha a mellkas röntgenfelvétele normális. Ez magában foglalhatja:
- Számítógépes tomográfia (CT) scan, amely több röntgenképet használ egy háromdimenziós kép létrehozásához
- Mágneses rezonancia képalkotás (MRI), amely erőteljes mágneses és rádióhullámok segítségével rendkívül részletes képeket készít a lágy szövetekről
- Bronchoscopy, amelyben a szájon át beillesztett és lefelé menő megvilágított hatókör a légúti szövetek közvetlen megjelenítéséhez
- Pozitronemissziós tomográfia (PET) scan, amely a rosszindulatú daganatok kialakulásakor gyakran előforduló anyagcsere-változásokat keresi
A vérvizsgálatokat nem használják a tüdőrák diagnosztizálására.
Ha a kezdeti képalkotó eredmények rákra utalnak, orvosa tüdőbiopsziát rendel el, hogy végleges bizonyítékot szolgáltasson a rosszindulatú daganatra. Ez magában foglalhatja a finom tűszívást (FNA), amelyben egy tűt helyeznek a mellkas falán keresztül a tumorba, hogy kis sejtmintát nyerjenek ki. Biopszia elvégezhető a bronchoszkópia során is, ha a légutakban a lehetséges rák látható jelei vannak.
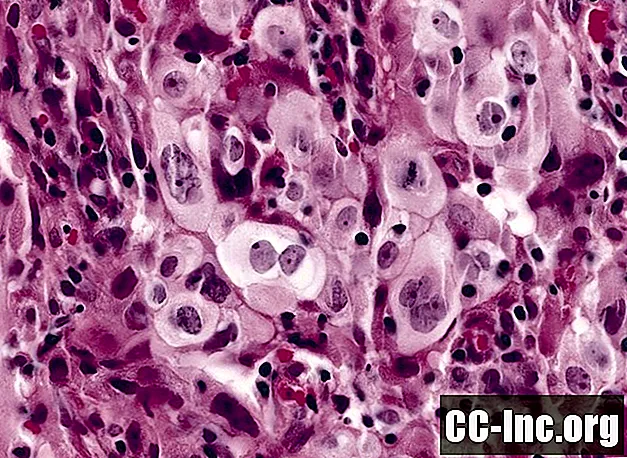
Az LCLC végleges diagnózisát a laboratóriumban úgy állíthatjuk fel, hogy a biopsziás sejteket mikroszkóp alatt vizsgáljuk. Az LCLC alkalmazásával a sejtek megnagyobbodnak és megkülönböztethetetlenek lesznek (vagyis alig vagy egyáltalán nem hasonlítanak a normál sejtekre).
Az olyan differenciálatlan rákos sejtek, mint az LCLC (más néven anaplasztikus sejtek) hajlamosak megosztani és gyorsan terjedni.
Szakasz
Az összes tüdőrák mértékét és súlyosságát négy szakaszra bontják, amelyek mindegyik szakasza a betegség progresszióját jelenti.
Az 1. stádiumtól kezdve, amelyben a rák a tüdőben lokalizálódik, és nem terjedt át egyetlen nyirokcsomóra sem, a 4. stádiumig, amelyben a rák a test távoli részeire terjedt át (áttétet adott).
A tüdőrák megmagyarázott 4 szakaszaKezelés
A rák stádiumától függően az LCLC kezelési lehetőségei közé tartozik a műtét, kemoterápia, sugárterápia, célzott terápia, immunterápia vagy ezek kombinációja. Klinikai vizsgálatok azok számára is rendelkezésre állnak, akik esetleg nem reagálnak a terápiára.
Sebészet
A tüdőrákos műtét a legjobb esélyt nyújtja a gyógyulásra, ha az LCLC-t a korai szakaszban elkapják. A műtéti lehetőségek a következők:
- Ék reszekció, a daganat eltávolítása a környező szövet ékével együtt
- Lobectomia, a tüdő lebenyének eltávolítása
- Pneumonectomia, egy teljes tüdő eltávolítása
Újabb, minimálisan invazív eljárás, ún video-asszisztált torakoszkópos műtét (VATS), már elérhető néhány rákközpontban. Ez magában foglalja a mellkas több kis bemetszését, és egy apró kamera (torakoszkóp) és műszerek használatával a műtétet a bordák eltávolítása vagy elválasztása nélkül.
Kemoterápia
A kemoterápia alkalmazható önmagában vagy műtéttel együtt. Használható műtét előtt is a daganat méretének csökkentésére (neoadjuváns kemoterápia), vagy műtét után annak biztosítására, hogy ne maradjanak rákos sejtek (adjuváns kemoterápia).
Hasonlóképpen, kemoterápia alkalmazható sugárterápiával vagy anélkül. Az LCLC kezelésére általánosan alkalmazott kemoterápiás gyógyszerek közé tartozik az Altima (pemetrexed) és a Platinol (ciszplatin).
Célzott terápiák
A célzott terápiák olyan gyógyszerek, amelyeket rákos sejtek megtámadására terveztek, és a normális sejteket nagyrészt érintetlenül hagyják. Emiatt a mellékhatások általában kevésbé súlyosak, mint a kemoterápiás gyógyszereknél.
A molekuláris profilalkotás, amely a tumorsejtekben specifikus DNS-mutációkat azonosít, meghatározhatja, hogy egy személy kezelhető mutációval rendelkezik-e, és hogy terápiás jelölt-e.
A molekuláris profilozás ajánlott mindenkinek, aki előrehaladott, nem kissejtes tüdőrákban szenved, beleértve az LCLC-t is. Ha kezelhető mutációt találnak, jó esély van arra, hogy a megcélzott gyógyszer egy ideig képes legyen irányítani a daganatot.
Míg a célzott gyógyszerek nem gyógyítják a tüdőrákot, addig képesek kordában tartani a rosszindulatú daganatot, amíg az ellenállás kialakul és a gyógyszer már nem működik.Amikor ez megtörténik, vannak második generációs, és egyes esetekben harmadik generációs gyógyszerek, amelyek felhasználhatók.
Az EGFR mutáció szerepe a tüdőrákbanSugárkezelés
A sugárterápiát számos különböző módon lehet alkalmazni tüdőrákkal. Használható műtét előtt a daganat méretének csökkentésére és műtét után a fennmaradó rákos sejtek felszámolására.
Kis daganatos megbetegedések esetén a sugárzás önmagában alkalmazható a sugárzás egy speciális formájának alkalmazásával, az úgynevezett sztereotaktikus test sugárterápiával (SBRT). Az SBRT nagyon magas dózisú sugárzást juttat a szövet lokalizált területére a rosszindulatú daganat gyógyítása céljából. Az SBRT alkalmazható tüdőrák okozta izolált metasztázisok kezelésére is, beleértve az agyat is.
A sugárterápia palliatív kezelésként is alkalmazható előrehaladott tüdőrákban szenvedők számára a tünetek kezelésére és az életminőség javítására.
Immun terápia
Az immunterápia egy izgalmas területe a tüdőrák kezelésének, amelynek eredményeként a betegek hosszú távú ellenőrzését eredményezték néhány, még a 4. stádiumú rákban szenvedők esetében is. Ezek a gyógyszerek a szervezet saját immunrendszerének kiaknázásával működnek a rák elleni küzdelemben.
2020-tól öt olyan immunterápiás gyógyszer létezik, amelyet az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) hagyott jóvá tüdőrák kezelésére:
- Imfinzi (durvalumab): Mind az előrehaladott nem kissejtes tüdőrák, mind a kissejtes tüdőrák esetében engedélyezett, ideértve az első vonalbeli terápiában történő alkalmazást is
- Keytruda (pembrolizumab): Jóváhagyva előrehaladott, nem kissejtes tüdőrák esetén, beleértve az első vonalbeli terápiát, és néhány kissejtes tüdőrákban szenvedő beteg számára
- Opdivo (nivolumab): Platina alapú kemoterápia és legalább egy másik kezelési módszer sikertelennek bizonyult mind az előrehaladott nem kissejtes tüdőrák, mind a kissejtes tüdőrák esetében.
- Tecentriq (atezolizumab): Mind az előrehaladott nem kissejtes tüdőrák, mind a kissejtes tüdőrák esetében engedélyezett, ideértve az első vonalbeli terápiában történő alkalmazást is
- Tecentriq (atezolizumab): Jóváhagyva az Opdivo-val előrehaladott, nem kissejtes tüdőrákban szenvedő betegek első vonalbeli kezelésére (kemóval vagy anélkül)
Prognózis
A tüdőrák stádiuma segíthet megjósolni a beteg hosszú távú kimenetelét, amelyet prognózisnak neveznek. A prognózist jellemzően az ötéves túlélési arány írja le, amely becsli a túlélők százalékos arányát legalább öt évvel a diagnózis után.
Mivel az olyan differenciálatlan rákok, mint az LCLC, agresszívek lehetnek, a túlélési arány általában gyengébb, mint néhány más típusú rák esetében. Ezzel azt mondták, hogy az újabb terápiák még a fejlett betegségben szenvedőknél is megkezdték a túlélési idő javítását.
Az American Cancer Society szerint és 2020 januárjától az LCLC-ben és más nem kissejtes tüdőrákokban, például az adenokarcinómában és a pikkelysmrben szenvedők esetében az ötéves túlélési arány:
- Lokalizált (1. szakasz): 61%
- Regionális (2–3. szakasz): 35%
- Távoli (4. szakasz): 6%
Az LCLC egyik változata, az úgynevezett nagysejtes neuroendokrin karcinóma általában rosszabb prognózissal rendelkezik, a túlélési idő mediánja nagyjából hat hónap.
A prognózis jelentősége a rákkalMegbirkózni
A tüdőrák diagnózisa ijesztő lehet, és nagyon egyedül érezheti magát. Engedje meg, hogy szeretteit támogassa.
Sok embernek fogalma sincs arról, hogyan reagáljon valakire, akinek rákot diagnosztizáltak. Ha megismerteti az embereket konkrét dolgokkal, amiket megtehetnek, ez segíthet enyhíteni a szorongást, és további támogatást nyújthat Önnek, amikor szüksége van rá.
Jobban megbirkózhat az LCLC-vel, ha minél többet megtud a betegségről és kérdéseket tesz fel. Fontolja meg, hogy csatlakozik egy tüdőrák támogató csoporthoz akár a kezelési központon keresztül, akár az interneten keresztül.
Ami a legfontosabb, ne feledje, hogy Ön ennek az útnak a kapitánya. Nem számít, amit mások tapasztaltak vagy ajánlottak, végül tudod, mi a legjobb neked.
Megbirkózni és jól élni a tüdőrákkalEgy szó Verywellből
Noha a tüdőrákban szenvedőknek korábban nem voltak kedvező prognózisai, a kezelések és a túlélési idő minden évben javul. Ezért fontos, hogy onkológiai csapata folyamatosan figyelemmel kísérje a legfrissebb kutatásokat. A tudomány ilyen gyors fejlődésével ez néha nehéz lehet.
Ha bizonytalan az ajánlott kezelési tervben, ne habozzon kikérni egy második véleményt, ideális esetben egy nagyobb Országos Rák Intézet által kijelölt kezelési központban. Az ottani onkológusok csapata valószínűleg ismeri a legújabb fejleményeket, és együtt dolgozhat a csapatával a legfrissebb és leghatékonyabb kezelési módszerek biztosításában.
A top 10 rákkórház az Egyesült Államokban